El principio de Le Châtelier describe lo que ocurre en las reacciones reversibles. Irónicamente, al intentar realizar una de las reacciones reversibles más importantes del planeta (véase la reacción para producir amoniaco), Le Châtelier fracasó. Se hizo un lío con el experimento que le habría permitido sintetizar la sustancia química que actualmente se encuentra en el centro de dos industrias globales: la de los fertilizantes y la del armamento. […]
La reacción para producir amoniaco
La reacción reversible para producir amoniaco es:
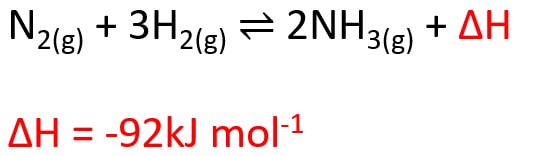
Se trata también de una reacción redox […] y también es una reacción exotérmica, lo que significa que pierde energía hacia su entorno y no requiere de mucho calor para iniciarse. Puede desarrollarse sin problemas a bajas temperaturas.
Sin embargo, para producir cantidades industriales de amoniaco se necesita calor. Aunque una temperatura más alta desplaza el equilibrio […] ligeramente a la izquierda, favoreciendo al nitrógeno y el hidrógeno, la reacción progresa mucho más deprisa, lo que significa que se produce mucho más amoniaco en menos tiempo.
[…]De no haber sido por la explosión casi mortal, Le Châtelier no habría abandonado sus investigaciones sobre el amoniaco. De hecho, el proceso de Haber, como dio en conocerse, aprovechaba las teorías del propio Le Châtelier. La reacción importante en la síntesis del amoniaco establece un equilibrio entre los dos reactivos (nitrógeno e hidrógeno) y el producto (amoniaco). Tal como predecía el principio de Le Châtelier, extraer uno de los productos altera el statu quo y lleva a que el equilibrio tienda a restablecerse. Así, en el proceso de Haber, el amoniaco se extrae constantemente para que se siga produciendo.
Haber utilizó un catalizador de óxido de hierro para acelerar su reacción. […]. Después de conseguir las primeras gotas de amoniaco en un experimento de laboratorio realizado en 1909, su colega Carl Bosch le ayudo a comercializar el proceso (a veces conocido como proceso de Haber-Bosch). Casi una década más tarde, Haber recibiría el premio Nobel de Química, […].
Fuente: Hayley Birch, 2016, 50 cosas que hay que saber sobre Química, Barcelona: Ariel Capitulo 17
Actividad a realizar con los alumnos: El proceso Haber
Objetivos:
- Comprender el concepto de equilibrio químico
- Aplicación del concepto de equilibrio químico a los procesos de fabricación
- Comprender el concepto de catalizador
- Comprender las posibles consecuencias del uso de fertilizantes sintéticos a nivel medioambiental
Desarrollo de la actividad
Se compone de las siguientes fases:
1. Visionado de los siguientes videos en grupos de 4/5 alumnos:
What is the Haber Process | The Chemistry Journey | The Fuse School. [Vídeo]. Recuperado de:
The Haber process and its environmental implications | The Chemistry Journey | The Fuse School. [Vídeo]. Recuperado de:
2. Búsqueda de información suplementaria que consolide los conceptos explicados en los vídeos anteriores
3. Realización de una presentación en powerpoint al resto de sus compañeros con posterior debate.
Criterios de evaluación:
- Elaborar una rubrica que permita la evaluación de las presentaciones de los diversos grupos.
- Realizar un test escrito.



Comentarios recientes